QUÍMICA ORGÂNICA III
A substituição de quatro átomos de hidrogênio do benzeno por quatro átomos de cloro fornece um número de isômeros de posição igual a:
3
5
2
4
6
Os ligantes presentes no anel aromático podem ser classificados como ativantes (orto para dirigentes) e desativantes (metadirigentes). Abaixo está representado uma sequência de reações de substituição eletrofílica em aromáticos. As reações ocorrem em duas etapas, onde na primeira etapa ocorre a formação de um produto intermediário e na segunda etapa formam-se os produtos finais dissubstituídos X, Y e Z, que são denominados respectivamente:
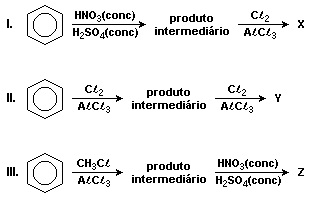
Metacloronitrobenzeno, metadiclorobenzeno e meta-nitrotolueno
Ortocloronitrobenzeno, ortodiclorobenzeno e paracloronitrobenzeno
Paracloronitrobenzeno, paradiclorobenzeno e ortonitrotolueno
Metacloronitrobenzeno, ortodiclorobenzeno e paranitrotolueno
Ortocloronitrobenzeno, metadiclorobenzeno e paranitrotolueno
As aplicações de destilação podem ser classificadas em dois grandes grupos: destilação em escala laboratorial e destilação industrial. Sobre os dois tipos de destilação é correto afirmar que:
Em escala laboratorial as destilações são realizadas geralmente em batelada e com elevado custo operacional.
Em escala laboratorial as destilações são realizadas geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada e com baixo rendimento.
Em escala laboratorial as destilações são realizadas geralmente contínuas.
Num laboratório, um aluno do curso de química deseja extrair de uma fase aquosa uma base fraca (uma amina do tipo RNH2). Para uma maior eficácia do processo, o aluno deve:
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Uma solução salina diluída.
Adicionar na fase orgânica polar contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de ácido clorídrico.
Adicionar na fase aquosa contendo a substância a ser extraída um solvente orgânico polar.
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na Antiguidade, predominando então o método de extração de essências pela infusão de flores em óleos ou gorduras.
Sobre a destilação, incorporada como um procedimento químico no século XVIII, marque a alternativa correta.
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:
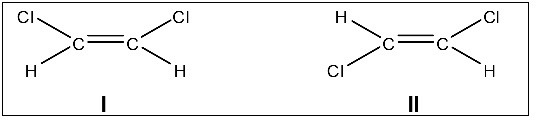
I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
3
5
2
4
6
Os ligantes presentes no anel aromático podem ser classificados como ativantes (orto para dirigentes) e desativantes (metadirigentes). Abaixo está representado uma sequência de reações de substituição eletrofílica em aromáticos. As reações ocorrem em duas etapas, onde na primeira etapa ocorre a formação de um produto intermediário e na segunda etapa formam-se os produtos finais dissubstituídos X, Y e Z, que são denominados respectivamente:

Metacloronitrobenzeno, metadiclorobenzeno e meta-nitrotolueno
Ortocloronitrobenzeno, ortodiclorobenzeno e paracloronitrobenzeno
Paracloronitrobenzeno, paradiclorobenzeno e ortonitrotolueno
Metacloronitrobenzeno, ortodiclorobenzeno e paranitrotolueno
Ortocloronitrobenzeno, metadiclorobenzeno e paranitrotolueno
As aplicações de destilação podem ser classificadas em dois grandes grupos: destilação em escala laboratorial e destilação industrial. Sobre os dois tipos de destilação é correto afirmar que:
Em escala laboratorial as destilações são realizadas geralmente em batelada e com elevado custo operacional.
Em escala laboratorial as destilações são realizadas geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada e com baixo rendimento.
Em escala laboratorial as destilações são realizadas geralmente contínuas.
Num laboratório, um aluno do curso de química deseja extrair de uma fase aquosa uma base fraca (uma amina do tipo RNH2). Para uma maior eficácia do processo, o aluno deve:
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Uma solução salina diluída.
Adicionar na fase orgânica polar contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de ácido clorídrico.
Adicionar na fase aquosa contendo a substância a ser extraída um solvente orgânico polar.
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na Antiguidade, predominando então o método de extração de essências pela infusão de flores em óleos ou gorduras.
Sobre a destilação, incorporada como um procedimento químico no século XVIII, marque a alternativa correta.
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:

Metacloronitrobenzeno, metadiclorobenzeno e meta-nitrotolueno
Ortocloronitrobenzeno, ortodiclorobenzeno e paracloronitrobenzeno
Paracloronitrobenzeno, paradiclorobenzeno e ortonitrotolueno
Metacloronitrobenzeno, ortodiclorobenzeno e paranitrotolueno
Ortocloronitrobenzeno, metadiclorobenzeno e paranitrotolueno
As aplicações de destilação podem ser classificadas em dois grandes grupos: destilação em escala laboratorial e destilação industrial. Sobre os dois tipos de destilação é correto afirmar que:
Em escala laboratorial as destilações são realizadas geralmente em batelada e com elevado custo operacional.
Em escala laboratorial as destilações são realizadas geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada e com baixo rendimento.
Em escala laboratorial as destilações são realizadas geralmente contínuas.
Num laboratório, um aluno do curso de química deseja extrair de uma fase aquosa uma base fraca (uma amina do tipo RNH2). Para uma maior eficácia do processo, o aluno deve:
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Uma solução salina diluída.
Adicionar na fase orgânica polar contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de ácido clorídrico.
Adicionar na fase aquosa contendo a substância a ser extraída um solvente orgânico polar.
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na Antiguidade, predominando então o método de extração de essências pela infusão de flores em óleos ou gorduras.
Sobre a destilação, incorporada como um procedimento químico no século XVIII, marque a alternativa correta.
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
Em escala laboratorial as destilações são realizadas geralmente em batelada e com elevado custo operacional.
Em escala laboratorial as destilações são realizadas geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada.
Em escala industrial as destilações são geralmente em batelada e com baixo rendimento.
Em escala laboratorial as destilações são realizadas geralmente contínuas.
Num laboratório, um aluno do curso de química deseja extrair de uma fase aquosa uma base fraca (uma amina do tipo RNH2). Para uma maior eficácia do processo, o aluno deve:
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Uma solução salina diluída.
Adicionar na fase orgânica polar contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de ácido clorídrico.
Adicionar na fase aquosa contendo a substância a ser extraída um solvente orgânico polar.
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na Antiguidade, predominando então o método de extração de essências pela infusão de flores em óleos ou gorduras.
Sobre a destilação, incorporada como um procedimento químico no século XVIII, marque a alternativa correta.
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Uma solução salina diluída.
Adicionar na fase orgânica polar contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de hidróxido de sódio.
Adicionar na fase aquosa contendo a substância a ser extraída uma fase orgânica apolar com posterior adição de solução de ácido clorídrico.
Adicionar na fase aquosa contendo a substância a ser extraída um solvente orgânico polar.
A destilação também era utilizada em manufaturas como, por exemplo, na preparação de perfumes, artes para a qual os árabes muito contribuíram. Havia grandes centros onde eram extraídos os aromas de rosas, violetas, jasmins e de outros materiais. Para isso, as flores eram maceradas em água e, em seguida, esse material era destilado. Tal processo não era utilizado na Antiguidade, predominando então o método de extração de essências pela infusão de flores em óleos ou gorduras.
Sobre a destilação, incorporada como um procedimento químico no século XVIII, marque a alternativa correta.
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
Uma técnica de separação que requer aquecimento da mistura homogênea ao longo do procedimento.
Era utilizada, na antiguidade, como principal método de extração das essências após se fazer uma mistura heterogênea.
É uma técnica ideal para extração de essências de rosas que, ao serem maceradas, tornam-se sistemas homogêneos com a água.
É uma técnica de separação baseada em reações químicas.
Possui uma etapa de resfriamento e, em seguida, de condensação da água onde estarão dissolvidas essências oleosas.
O etanol (álcool etílico) é um álcool muito importante na nossa sociedade, pois possui diversas aplicações, sendo usado como solvente industrial, combustível veicular, em bebidas, em assepsia, etc. É um combustível “verde”, ecológico, renovável, obtido por meio da fermentação do açúcar da cana, beterraba, milho ou arroz. Quando oxidado produz o vinagre, nome popular dado ao ácido etanóico ou ácido acético. A propósito, assinale a alternativa que representa a oxidação do álcool etílico.
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
CH3CH2OH + H2O → CH3COOH + O2
CH3CH2CH2OH + O2 → CH3CH2COOH + H2O
CH3OH + CO → CH3COOH
CH3CH2OH + O2 → CH3COOH + H2O
CH3COOH + H2O → CH3CH2OH + O2
O metilbenzeno (tolueno) é um solvente industrial importante e sofre reação com cloro na presença de catalisador, fornecendo produtos monoclorados, isto é, monoclorotoluenos. Sobre estes produtos, podemos afirmar que:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
Os isômeros do clorotolueno formados possuem o mesmo valor de momento dipolar.
Um dos produtos monoclorados formados é o p-clorotolueno (1–cloro–4–metil–benzeno).
São formados cinco produtos monoclorados.
O isômero o-clorotolueno (1–cloro–2–metil–benzeno) forma ligação de hidrogênio intramolecular.
Os isômeros monoclorados formados são apolares.
Um determinado composto orgânico, dissolvido em 100 ml de uma solução aquosa (pH =7), foi submetido a uma extração líquido-líquido utilizando 100 ml de octanol. Sabe-se que a razão de distribuição para o analito é de 1/80. Considerando que, na fase aquosa, há 5 g do composto orgânico, o peso restante da amostra na fase aquosa e o peso extraído na fase orgânica após uma única extração é respectivamente:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g
Considere as seguintes afirmações sobre os compostos I e II apresentados a seguir:

I. A molécula do composto I é apolar.
II. Os compostos I e II apresentam propriedades físicas e químicas idênticas.
III. Os compostos I e II são isômeros cis-trans.
IV. Os nomes dos compostos I e II são, respectivamente, cis-1,2-dicloroeteno e trans-1,2- dicloroeteno.
Está correto apenas o que se afirma em:
0,0310 g e 4,969 g
4,9383 g e 0,0617 g
0,0617 g e 4,9383 g
4,969 g e 0,0310 g
0,123 g e 4,877 g